Tissue Engineering
Forschungsaktivitäten Kluger-Lab
Der Forschungsschwerpunkt liegt vor allem im Bereich Tissue Engineering, wie beispielsweise die Nachbildung menschlicher Haut, um eine Alternative zu Tierversuchen zu schaffen. Darüber hinaus beschäftigt sich das Kluger-Lab mit der Frage, wie sich echtes Fleisch ganz ohne Tierleid aus Zellen im Labor züchten lässt. Fertigungsverfahren wie der 3-D-Druck stehen dabei im Fokus.
Aktuelle Forschungsprojekte
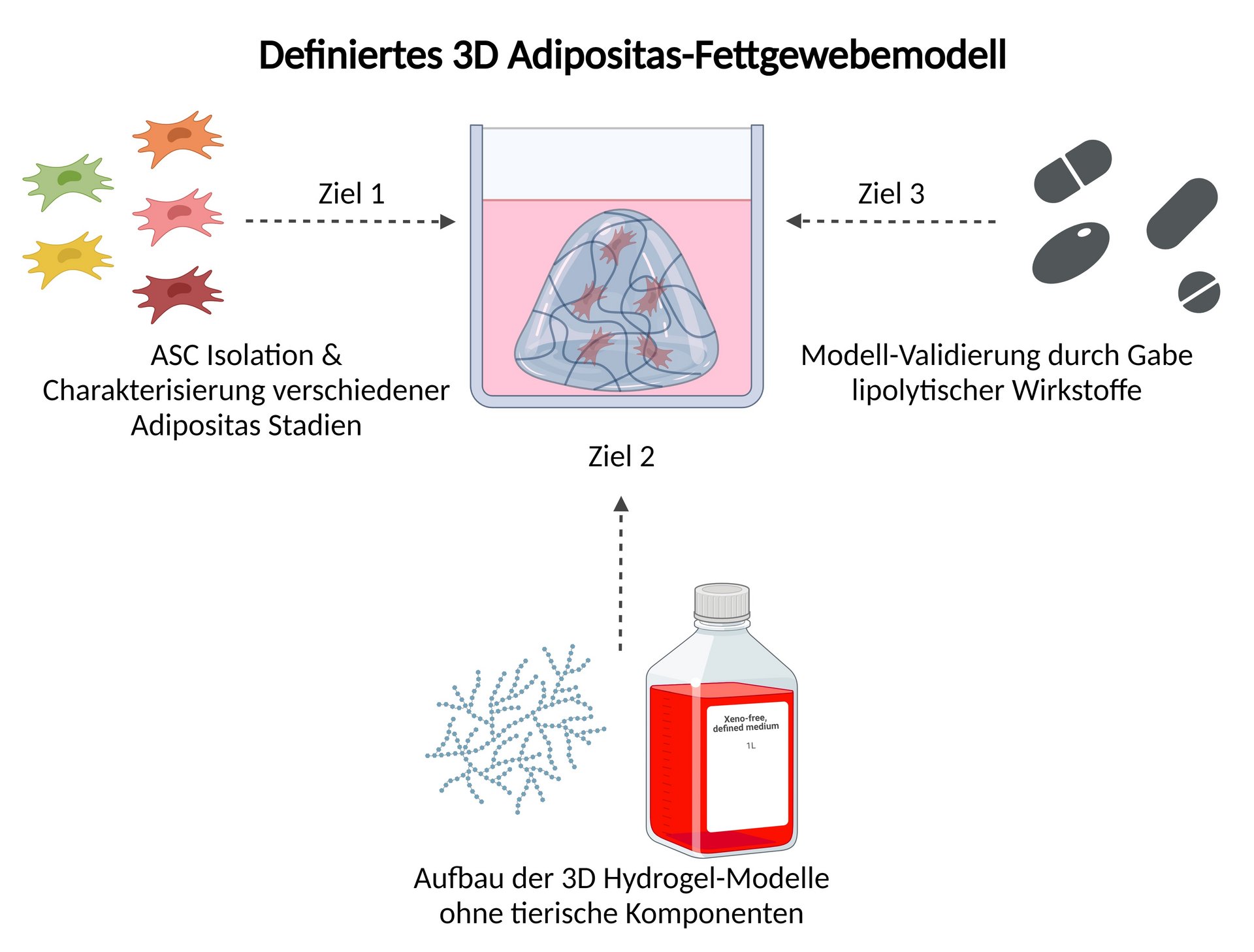
Im Projekt Adipositas 3D soll ein humanes 3D Adipositas-Fettgewebemodell ohne tierische Komponenten aufgebaut werden. Dieses Hydrogel-Modell wird mit primären Stammzellen von adipösen Spendern aufgebaut, und soll zur Testung von lipolytischen Wirkstoffen herangezogen werden und somit die Funktionalität des in vitro Modells als Alternative zum Tierversuch bestätigen.
Im Projekt werde die folgenden Ziele verfolgt:
- Die Isolation von primären humanen Stammzellen aus dem Fettgewebe (ASCs) von adipösen und nicht-adipösen Spendern sowie die Einordnung und Charakterisierung der isolierten Zellen anhand ihrer Krankheitsstadien
- Der Aufbau von humanen 3D in vitro Modellen, ohne tierische Komponenten, mit den charakterisierten Zellen und die Überprüfung des Zellstatus
- Validierung der 3D Modelle durch die Zugabe von lipolytischen Wirkstoffen und die Untersuchung der Auswirkung auf die entsprechenden Adipositas-Zustände
Projektzeitraum: 12/2023, Laufzeit 2 Jahre
Kontakt: Petra Kluger, Franziska Albrecht
INVERS- In-vitro Erzeugung von smarten Fischproteinen: Etablierung von Fettvorläuferzellen aus lachsartigen Fischen für die Entwicklung nachhaltiger, hochwertiger Fischlebensmittel
Fischprodukte sind integraler Bestandteil der menschlichen Ernährung. Global wurden 2018 ca. 156 Mio. Tonnen Fisch konsumiert, was einer Verdopplung des Konsums in den letzten 60 Jahren auf rechnerisch 20,5 kg pro Person entspricht. Fischprodukte sind eine wichtige Quelle für die Nährstoffversorgung (FAO 2020). Dies gilt insbesondere für „ölige“ Fische wie Lachs, Forelle und Makrele, da sie im Fettgewebe große Mengen an mehrfach ungesättigten, Omega-3 Fettsäuren enthalten. Jedoch ist eine dauerhafte Versorgung mit gesunden Fischlebensmitteln nicht sichergestellt. Mehr als 30% der globalen Fischbestände gelten als überfischt und weitere 60% als maximal an die Bestandsgrenzen befischt (FAO 2020). Hinzu kommt, dass insbesondere fettreiche Fische dazu neigen, permanente Umweltgifte wie Quecksilber und Dioxin im Gewebe einzulagern. Es bedarf daher neuer Ansätze, um eine nachhaltige Versorgung mit gesunden Fischlebensmitteln sicherzustellen, zumal die Züchtung von Fischen in Aquakulturen – als Alternative zum Wildfang – mit diversen negativen Umwelteffekten einhergeht und Haltungsbedingungen aus tierethischer Perspektive fragwürdig sind.
Mit der in-vitro Technologie existiert ein neuer Ansatz zur Erschließung alternativer Proteinquellen, der zu einer nachhaltigen Versorgung mit qualitativ hochwertigen Fischlebensmitteln beitragen kann. Bei diesem Ansatz wird einem Fisch zunächst Gewebe entnommen. Aus dem Fischgewebe werden im nächsten Schritt Vorläufer- bzw. Stammzellen gewonnen, die dann unter kontrollierten Bedingungen vermehrt werden. In Bioreaktoren werden die Zellen mit Nährstoffen versorgt. Anschließend kann die Zellbiomasse für die Erzeugung von unstrukturierten Fischlebensmitteln geerntet werden. Die nachfolgende Grafik stellt die konventionelle Fischlebensmittelproduktion einer in-vitro Erzeugung gegenüber. Mittels in-vitro Technologie können Fischlebensmittel erzeugt werden, die in funktionaler Hinsicht, d.h. in Bezug auf ernährungsphysiologische Wertigkeit, Geschmack, Aussehen und Geruch mit heutigen Produkten nahezu identisch sind. Mittels in-vitro Technologie können Fischlebensmittel mit einem Bruchteil der Fischmengen hergestellt werden, die heute produziert oder gefangen werden, sodass der Fischfang reduziert und der aktuellen Überfischung entgegengewirkt werden kann. Da die in-vitro Erzeugung unter kontrollierten Bedingungen erfolgt, sind die Produkte frei von Umweltgiften und es bedarf keines Einsatzes von Medikamenten. Schließlich leistet die in-vitro Erzeugung einen substanziellen Beitrag zum Tierwohl, da es weder einer Intensivfischhaltung noch der massenhaften Tötung von Fischen bedarf.
Kontakt: Petra Kluger
Erfolgreich abgeschlossene Forschungsprojekte - Biomedizin
Lungen-Fettmodell-Medien- Entwicklung eines neuartigen in vitro Lungen-Fettgewebemodells und definierter Zellkulturmedien zur Untersuchung des Einflusses von Adipositas auf Lungenerkrankungen
Adipositas ist eine komplexe Erkrankung mit einer Vielzahl von assoziierten Komorbiditäten, die den Stoffwechsel, zahlreiche Organe und Organsysteme betreffen. In den letzten Jahren, weisen zahlreiche Studien zunehmend auf eine wichtige Bedeutung bei Lungenkrankheiten hin. Der chronisch entzündliche Zustand im adipösen Fettgewebe wird dabei häufig als wichtiger Faktor für eine Wechselwirkung zwischen Fettgewebe und Lunge diskutiert. Es ist aber immer noch unklar, wie das entzündliche adipöse Fettgewebe und pathologische Zustände der Lunge in Verbindung stehen. Aufgrund der erwähnten komplexen Pathologie von Adipositas, ist die Aufklärung über ursächliche Zusammenhänge mit Tierversuchen und Patientendaten häufig kaum möglich. Zudem existiert im Moment kein humanes in vitro Gewebemodell aus Lungen und Fettgewebe, das als Testsystem verwendet werden kann. Hinzu kommt, dass humane in vitro Testsysteme aufgrund der Verwendung von FCS im Medium in ihrer Aussagekraft eingeschränkt sind. Es besteht daher ein zunächst einmal ein dringender Bedarf an definierten Zellkulturmedien um in vitro Testsysteme etablieren zu können, die aussagekräftige und reproduzierbare Ergebnisse liefern.
Die Haut ist das größte Organ des menschlichen Körpers und besteht aus drei verschiedenen Schichten - Epidermis, Dermis und Subkutis. Sie stellt die erste Kontaktfläche zur Umwelt dar und bildet eine Barriere gegen schädliche Einflüsse. Daher ist die Haut für verschiedene Branchen wie Chemie, Pharma oder Kosmetik von großem Interesse und Tierversuche sind in diesen Bereichen zum Teil noch üblich. Seit dem Verbot von Tierversuchen für Kosmetika und strengeren gesetzlichen Regelungen steigt der Bedarf an validen Alternativen zu Tierversuchen wie In-vitro-Testsystemen.
In dem bereits abgeschlossenen Vorgängerprojekt "Fat2Skin" wurde erfolgreich ein dreischichtiges humanes in vitro Hautmodell für die topische Applikation von irritierenden Substanzen etabliert und weiterentwickelt. Der Aufbau des Hautmodells ist dabei mit der in vivo Situation vergleichbar. Zusätzlich befindet sich zwischen Epidermis und Dermis eine künstliche Basallamina, die eine für Substanztests optimierte, dicht geschlossene Epidermisschicht ermöglicht.
Das dreischichtige in vitro Hautmodell ist ein vielseitiges Werkzeug und kann für ein breites Spektrum von Anwendungen weiter angepasst werden. Bei der Wundheilung und Sensibilisierung spielt das Immunsystem der Haut eine zentrale Rolle bei der Vermittlung von Heilungs- und Sensibilisierungsprozessen. Daher ist die Integration von Immunzellen zum in vitro Hautmodell eine Voraussetzung für die Simulation einer physiologischeren Umgebung. Im Projekt "Immune-Fat2Skin" soll ein immunkompetentes dreischichtiges in vitro Hautmodell entwickelt werden, indem Immunzellen wie Langerhans-Zellen in den epidermalen und Makrophagen in den dermalen Teil des Modells eingebaut werden. Dieses immunkompetente Hautmodell soll dann durch histologische und immunologische Techniken charakterisiert und schließlich für Wundheilungs- und Sensibilisierungsstudien validiert werden.
Projektzeitraum: 05/2020 bis 04/2022
Finanzierung: Ministerium für Ernährung, Ländlichen Raum und Verbraucherschutz Baden-Württemberg
Kontakt: Petra Kluger, Sophia Nowakowski
Ziel dieses Kooperationsprojekts zwischen den Hochschulen Aalen und Reutlingen ist die Erforschung und Entwicklung eines 6D Drucksystems für biologische Systeme zur Weiterentwicklung bisheriger Druck- und Auswertetechniken im Tissue Engineering. Als Basis dient ein 6D FDM Drucker, für den eine passende Druck- und Messeinheiten für biologische Systeme entwickelt wird, um neue biomedizinische Produkte und Qualitätsansprüche zu realisieren.
Hierfür sind eine Freiformbahnführung und eine passende Qualitätssicherung mit nicht invasiven online Messverfahren notwendig. Ideal ist eine Prozessoptimierung durch Rückkopplung und die Nachsteuerung während des Prozesses durch parallele Analyse. Als Ergebnisse sollen nach zwei Jahren die Konzeption, Entwicklung und der Test eines 6D Druckdemonstrators für biologische Materialien sowie ein Prototyp eines OCT-Moduls zur Qualitätssicherung vorliegen.
Übergeordnete Ziele dabei sind:
- die flexible Automatisierung um eine gesteigerte Reproduzierbarkeit und ein Hochskalieren für größere biologische Materialverbünde zu erzielen.
- in der Zukunft komplexe biomedizinische Produkte wie beispielsweise der 3D-Druck von biologischem Material im Operationsraum direkt in den Patienten z.B. auf einer Brandwunde am Arm.
Projektlaufzeit: 05/2020 bis 05/2022
Fördermittel: Ministerium für Wissenschaft, Forschung und Kunst Baden-Württemberg, Paul Hartmann AG
MicroLungDetect - Entwicklung und Validierung eines “Lungen-Mikrochips” zur präklinischen Detektion von Medikamenten in der Atemluft
Ziel des interdisziplinären Projektes ist die Etablierung eines Lungenmikrochips für den Einsatz in der präklinischen Atemgasanalyse. Die Arbeit ist eine Kooperation des Kluger-Labs und des Kemkemer-Labs.
Üblicherweise erfolgt die Dosierung von Medikamenten abhängig vom Körpergewicht oder der Wirkung. Die begleitende Messung der Blutkonzentrationen ist zeitaufwendig, invasiv und teuer. Zudem liegen die Ergebnisse erst mit erheblicher Zeitverzögerung vor. Die Messung der Medikamentenkonzentrationen in der Ausatemluft stellt einen vielversprechenden Ansatz in der individualisierten Medizin dar und erlaubt es, die zuvor genannten Nachteile zu beseitigen.
Daher wird dringend ein in vitro Lungenmodell benötigt, um den systematischen Medikamentenübergang vom "Blut" durch das Gewebe in die "Ausatemluft" zu untersuchen. Um ein physiologisches und in vivo nahes Alveolar-Modell aufzubauen, muss dieses mittels eines Chips mit einer Membran und einer Endothel-Epithel-Co-Kultur simuliert werden. Der Fokus liegt dabei auf der Ausbildung eines dichten und konfluenten Zellmonolayers von Endothel und Epithelzellen, da dies eine Grundvoraussetzung für die zukünftige Vorhersagekraft des Modells ist. Darüber hinaus soll das Modell langzeitstabil sein und mindestens zwei Wochen in vitro persistieren.
Projektlaufzeit: 03/2018 bis 02/2021 (Verlängerung bis 12/2021)
Förderung: Baden-Württemberg Stiftung
Kontakt: Petra Kluger, Simon Heine
EntdefFett - Aufbau eines entzündlichen Fettgewebemodells in serumfreien Zellkulturmedien
Dieses Projekt wird vom Ministerium für Forschung, Wissenschaft und Kunst Baden-Württemberg und vom Europäischen Fonds für regionale Entwicklung gefördert.
Die Hauptziele innerhalb des Projektes sind
- Die Entwicklung von serumfreien Medien für die Mono- und Co-Kultur von reifen Adipozyten und einer Monozytenzelllinie
- Aufbau eines 3D-Fettgewebemodells auf Basis von reifen Fettzellen mittels additiver Fertigung
- Aufbau eines entzündlichen Co-Kulturmodells unter serumfreien Bedingungen
Entzündetes Fettgewebe wird mit vielen Krankheiten wie Diabetes oder Pankreatitis in Verbindung gebracht. In-vitro-Modelle von entzündlichem Fettgewebe können helfen, die Stoffwechselprozesse hinter der Entwicklung und Manifestation von Entzündungen im Fettgewebe aufzudecken. Darüber hinaus könnten solche Modelle genutzt werden, um nach neuen Medikamenten zu screenen, die diese pathologischen Veränderungen adressieren.
Das Ziel dieses Projektes ist der Aufbau eines neuartigen humanen Testsystems für entzündliches Fettgewebe. Dazu wird die Entwicklung von definierten Zellkulturmedien (frei von tierischem Serum) durch eine prozessbegleitende Analyse angegangen.
Um dieses ehrgeizige Ziel zu erreichen, werden die Hochschule Reutlingen und Esslingen und PELOBiotech ihre anwendungsorientierte Zusammenarbeit intensivieren. Es werden definierte Medien entwickelt und in der Adipozyten- und Monozytenzellkultur getestet. Begleitend dazu wird der Prozess anhand verschiedener Parameter an der Hochschule Esslingen analysiert. Die Möglichkeit, solche Modelle mit hoher Reproduzierbarkeit hochzuskalieren, würde den Markteintritt (z.B. in die pharmazeutische Industrie) wesentlich erleichtern. Um die standardisierte Herstellung von entzündeten Fettgewebsmodellen zu erleichtern, wird parallel dazu der Aufbau von 3D-Hydrogelen mit reifen Adipozyten vorangetrieben.
Projektlaufzeit: 05/2018 bis 12/2020
Fördermittel: Ministerium für Forschung, Wissenschaft und Kunst Baden-Württemberg und durch den Europäischen Fonds für regionale Entwicklung.
Kontakt: Svenja Nellinger
AdipoDiff - Entwicklung und Evaluierung neuer Zellkulturmedien und Matrizen für die Differenzierung, Langzeit- und Co-Kultur von Stammzellen aus dem Fettgewebe
Im Rahmen dieses Projektes wurden neue Zellkulturmedien und Matrizen auf ihre Eignung für die Differenzierung, Langzeit- und Co-Kultur von adipösen Stammzellen entwickelt und evaluiert. Dabei wurde sich auf die Differenzierung zu Endothelzellen und reifen Adipozyten und deren Co-Kultur konzentriert, was für klinische Anwendungen in der regenerativen Medizin oder für neue in vitro Testsysteme von großem Interesse ist. Das Projekt war eine Kooperation mit den Biotech-Unternehmen Bioregeneration und PELOBiotech.
Projektlaufzeit: 11/2014 bis 10/2017
Fördermittel: Bundesministerium für Bildung und Forschung
Kontakt: Petra Kluger
GlycoECM - Herstellung und Anwendung einer Glyko-funktionalisierten Extrazellulären Matrix
Die klinische Behandlung von tiefen und großflächigen Wunden, z. B. nach Verbrennungen, ist immernoch eine Herausforderung. Wünschenswert wäre hier ein hochkompatibles biologisches Material, das die Heilung der Wunde mit körpereigenen Zellen unterstützt.
Ziel des Projektes ist die Entwicklung eines solchen neuen Materials auf Basis einer gewebespezifischen extrazellulären Matrix (ECM) aus patienteneigenen Zellen. Diese natürliche ECM soll mit Hilfe der Glykobiologie modifiziert und optimiert werden. Zunächst werden durch metabolisches Glykoengineering funktionelle chemische Gruppen in die ECM eingebaut. Diese funktionellen Gruppen können durch biorthogonale Ligationsreaktionen adressiert werden und ermöglichen so die Kopplung von z.B. adhäsionsunterstützenden Oligosacchariden. Weiterhin können die funktionellen Gruppen zur Immobilisierung der ECM auf verschiedenen Materialien, z. B. künstlicher Haut, genutzt werden. Ein weiteres Ziel ist die Modifikation der ECM mit photovernetzenden Polymeren, um ein Material zu schaffen, das nach der Applikation geliert und eine optimale Ausfüllung der Wunde erreicht.
Projektlaufzeit: 06/2017 bis 06/2020
Fördermittel: Ministerium für Wissenschaft, Forschung und Kunst
Kontakt: Petra Kluger, Svenja Nellinger
Die menschliche Haut stellt die Hauptkontaktfläche zur Umwelt und eine Barriere gegenüber schädlichen äußeren Einflüssen dar. In der chemischen, kosmetischen und pharmazeutischen Industrie erfolgt die Einstufung der Toxizität einer Substanz meist über Hautreaktionen. Aus Mangel an adäquaten Alternativen werden nach wie vor eine Vielzahl von Tierversuchen durchgeführt. Aufgrund von Interspezies-Varianzen ist die Übertragbarkeit der Ergebnisse auf das menschliche System nur bedingt möglich.
Bestehende zellbasierte 2-schichtige (Epidermis und Dermis) humane In-vitro-Hautmodelle stellen eine gute Alternative dar. Allerdings spielt auch das subkutane Fettgewebe (Unterhaut) eine wesentliche Rolle bei der Speicherung und Umwandlung verschiedener Substanzen und beeinflusst als endokrines Organ die Hautreaktion. Um die Zuverlässigkeit und Vergleichbarkeit solcher Tests mit der menschlichen Haut zu erhöhen, wird dringend ein 3-schichtiges menschliches Hautmodell einschließlich der Subkutis benötigt. Ziel des Projektes ist es, ein dreischichtiges in vitro-Hautmodell zu etablieren und als Testsystem zu validieren. Weiterhin soll das etablierte Testsystem zur Untersuchung des Einflusses von feinstaubassoziierten Substanzen auf die menschliche Haut genutzt werden.
Projektlaufzeit: 11/2017 until 10/2019
Fördermittel: Ministerium für Ländlichen Raum und Verbraucherschutz
Kontakt: Petra Kluger
Erfolgreich abgeschlossene Forschungsprojekte - Cultured Meat
Nachhaltiges Fleisch - Nachhaltige Nährböden für die industrielle Produktion von Frischfleisch
Im Labor gezüchtetes, „sauberes“ Fleisch bietet eine Möglichkeit den zukünftigen Ernährungsbedarf decken und gleichzeitig die Umweltprobleme der konventionellen Fleischproduktion überwinden. Außerdem können Verbraucherwünsche durch nachhaltige biotechnologische Produkt- und Prozessinnovationen erfüllt werden. Die derzeitige Labor- Fleischproduktion erfordert jedoch große Mengen Nährmedium, das mit tierischem Serum und oder kostenintensiven Zusatzstoffen supplementiert ist. Für die nachhaltige industrielle Produktion von Fett- und Muskelzellen als Basis für die Fleischproduktion aus dem Labor werden in naher Zukunft große Mengen an ressourcenschonenden und gleichzeitig kosteneffizienten Nährmedien benötigt. Hierfür sollen regionale, bereits vorhandene biologische Ressourcen effizient genutzt werden. Dies können z.B. verschiedenste Pflanzenextrakte oder Neben- und Abfallprodukte aus der ländlichen Biomasseproduktion oder der Lebensmittelindustrie in Baden-Württemberg sein.
Die Ziele der Machbarkeitsstudie Nachhaltiges Fleisch sind:
1. die Identifizierung von kosten- oder energieintensiven Komponenten in den etablierten Kulturmedien zur Kultivierung von tierischen Fett- oder Muskelzellen.
2. die Identifizierung von Biomasse aus dem ländlichen Raum, die als Neben- oder Abfallprodukt zur Verfügung steht, für die Entwicklung nachhaltiger Nährmedien.
3. die Reduktion von kosten- und energieintensiven Komponenten in den etablierten Kulturmedien von Fett- und Muskelzellen unter Beibehaltung zelltypischer Parameter.
4. die Erstellung eines detaillierten Bewertungskatalogs zur Abschätzung der Marktpotenziale verschiedener Lösungen für die Herstellung eines nachhaltigen Nährbodens auf Basis regionaler Biomasse.
Um die angestrebten Ziele zu erreichen, arbeitet das Kluger-Lab eng mit der Firma PELOBiotech GmbH zusammen, die über langjährige und fundierte Erfahrungen auf dem Gebiet der Medienentwicklung, insbesondere mit serumfreien Medienformulierungen, verfügt. Die entwickleten Kulturmedien sollen die Kultivierung von tierischen Fett- und Muskelzellen ermöglichen, sowie nachhaltig, tierversuchsfrei und kostengünstig zu produzieren sein.
Projektlaufzeit: 12/2020 bis 08/2021
Kontakt: Simon Heine, Petra Kluger
Die Produktion von konventionellem Fleisch in der Nutztierhaltung hat große Auswirkungen auf die Umwelt, z.B. auf Treibhausgasemissionen, Wasserverbrauch und Erosion der globalen Landfläche. Da die Weltbevölkerung stetig wächst, heizt die steigende Nachfrage nach Fleischprodukten die weitere Ausbeutung von Ressourcen an und reduziert die Möglichkeit einer tierschutzgerechten Tierhaltung weiter. Aus diesen Gründen müssen alternative Fleischprodukte gefunden werden. Eine dieser Alternativen ist die Entwicklung von Fleischprodukten, die im Labor in vitro hergestellt werden. Diese Produkte werden als "Cultured Meat" bezeichnet. Die Strategie dabei ist, eine kleine Menge an Fett- und Muskelzellen aus tierischem Gewebe zu isolieren und in vitro zu kultivieren, um eine entsprechende Zellmasse zu erreichen. Anschließend können diese Zellen verarbeitet werden, z. B. durch Bioprinting, um ein Cultured Meat-Produkt für den Verzehr herzustellen.
Das Ziel dieses Projektes ist es, ein solches Produkt herzustellen, indem die zuvor isolierten Fett- und Muskelzellen als kleine, runde Zellaggregate (Sphäroide) kultiviert werden. Für die Hochskalierung sollen diese Sphäroide in ein Bioreaktorsystem überführt werden. Zur weiteren Verarbeitung können die Sphäroide in ein Biodruck-Verfahren zur Herstellung von 3D-Fleischkonstrukten einbezogen werden. Dazu sollen die Sphäroide mit Biomaterialien kombiniert werden, um gedruckt werden zu können. Die Hauptanforderungen an geeignete Biomaterialien sind: Lebensmitteltauglichkeit, Biokompatibilität, Druckbarkeit und sie sollten keine tierischen Bestandteile enthalten. Generell sollten die verwendeten Komponenten und der gesamte Herstellungsprozess umweltverträglich und kostengünstig sein, um ein erschwingliches in vitro Fleischprodukt zu erhalten.
Dieses Projekt wird in Zusammenarbeit mit Prof. Dr. Jan Frank und Dr. Monika Bach von der Universität Hohenheim durchgeführt.
Projektlaufzeit: 04/2020 bis 04/2023
Finanzierung: Avina Stiftung
Kontakt: Petra Kluger, Simon Heine
Serumfreies 3D-biogedrucktes Fleisch - Entwicklung eines serumfreien Co-Kulturmediums, von Biotinten und eines vereinfachten CAD-Modells für den Fleischdruck
Dieses Projekt wird von der Non-Profit-Organisation New Harvest finanziert und beinhaltet vier Hauptarbeitspakete. Unsere Ziele in diesem Projekt sind:
- Etablierung der Isolierung und Kultur von tierischen Vorläuferzellen von Muskel- und Fettzellen sowie deren Co-Kultur
- Entwicklung eines serumfreien Mediums für Muskel- und Fettzellen
- Entwicklung von muskel- und fettzellhaltigen Biotinten
- CAD-Modell und Druck von vereinfachten 3D-Einheiten der natürlichen Fleischstruktur
Im Rahmen des Projektes wird der Ansatz verfolgt, ein fleischähnliches 3D-Konstrukt zu drucken, das die natürliche Struktur und Textur von Fleisch imitiert. Für die Konstruktion des Fleischmodells werden Fett- (Adipozyten) und Muskelzellen (Myozyten) als Grundeinheit verwendet. Dazu werden die benötigten teilungsfähigen Vorläuferzellen (Adipose derived stem cells (ASCs) und Satellitenzellen) aus Schweine- oder Rindergewebe isoliert. Anschließend werden diese beiden Zelltypen zur Differenzierung in reife Adipozyten (aus ASCs) und Muskelzellen (aus Satellitenzellen) stimuliert. Im nächsten Schritt soll ein Co-Kulturmedium für beide Zelltypen entwickelt werden. Für das gesamte Projekt ist es wichtig, dass alle beteiligten Materialien neben den verwendeten Zellen kostengünstig sind und aus nicht-tierischen Quellen stammen. So können die neuen Ansätze zur Fleischproduktion möglichst unabhängig von der Tierhaltung sein. Im Speziellen ist es notwendig, häufig verwendete tierische Produkte (wie fötales Rinderserum, FBS) aus Kulturmedien durch nicht-tierische Alternativen zu ersetzen. Diese Medienadaption hilft, die Qualität des Produktes weiter zu standardisieren und zu erhöhen. Darüber hinaus müssen praktikable Biotinten, die auf nicht-tierischen Materialien basieren, identifiziert und adaptiert werden. Diese entwickelten "Muskel"- und "Fett"-Biotinten werden in einem 3D-Biodrucker weiterverarbeitet, um vereinfachte funktionale 3D-Fleischeinheiten herzustellen, die die Form und Textur von natürlichem Fleischgewebe imitieren. Hierzu werden CAD-Modelle entworfen und getestet, die eine vereinfachte geometrische Information über Form und Zusammensetzung der Muskel- und Fettkompartimente im Fleisch liefern. Die angestrebten Ergebnisse dieses Projektes (kostengünstige definierte Medien, tierfreie Biotinten, CAD-Modelle und gedruckte Funktionseinheiten von Fleisch) werden die Grundlage für den 3D-Biodruck von Fleisch bilden.
Projektlaufzeit: 09/2019 bis 12/2022
Finanzierung: New Harvest
Kontakt: Petra Kluger, Jannis Wollschlaeger
Presseberichte
Bei tagesschau.de: Ersatzfleisch aus dem 3D-Drucker, ganz ohne Tierquälerei und Antibiotika. Prof. Dr. Petra Kluger erklärt.
Fleisch aus dem Bioreaktor könnte die Ernährung revolutionieren. Keine Kuh, kein Schwein, kein Huhn müsste dafür sterben.
Podcast DREIMAL BESSER im BR
Was Laborfleisch kann - und was nicht. Ein Bericht bei der Deutschen Welle klärt auf.
Im Podcast von radioeins
Bei ZDF TerraXplore: Ist Fleisch aus dem Labor eine gute Alternative? Prof. Petra Kluger gibt aufschlussreiche Antworten.
In der WELT berichtet Prof. Kluger über ihre Forschung an Laborfleisch
Fleisch, für das keine Tiere sterben - Prof. Kluger im Interview mit der Südwest Presse
Hochschule Reutlingen züchtet Fleisch im Labor - Beitrag im Reutlinger Generalanzeiger
Reportage in der Stuttgarter Zeitung
SWR2 Science Talk klärt auf
Prof. Kluger im ZDF bei Leschs Kosmos
Wie das Fleisch der Zukunft aussehen kann, erklärt Prof Petra Kluger in ZDF NANO.
Ist Laborfleisch die Lösung? In SWR Wissen erklärt Prof. Kluger ihre Forschung
Im IHK-Wirtschaftsmagazin ist Prof. Dr. Petra Kluger im Gespräch
Bericht in der Frankfurter Allgemeinen Sonntagszeitung
Bericht im Kölner Stadtanzeiger über künstlich entwickeltes Fleisch im Labor
Prof. Kluger zu Gast bei einer stern-DISKUTHEK-Folge
Artikel im Steinbeis-Transfermagazin erschienen: Die Forscher an der Hochschule Reutlingen haben Tierwohl und Umweltschutz im Blick
Team
Hinter jedem Forschungsprojekt steht ein starkes Team.